细胞膜的物质转运功能
一、细胞膜的化学组成及其分子排列形式
细胞膜(cell membrane)也称质膜(plasma membrane),是分隔细胞质与细胞周围环境的一层膜结构。
细胞膜和细胞内各种细胞器的膜结构及其化学组成是基本相同的,主要由脂质和蛋白质组成,还有少量糖类物质。一般而言,在功能活跃的细胞,膜蛋白含量较高;而在功能简单的细胞,膜蛋白含量相对较低。
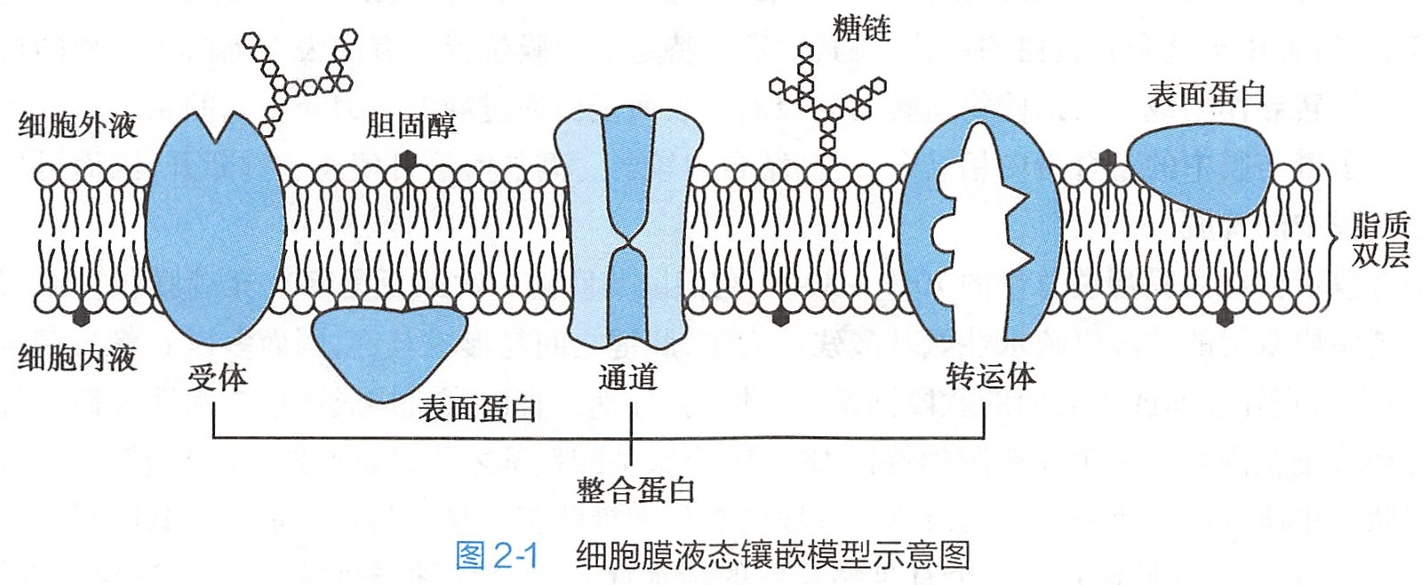
关于各种化学成分在膜中排列的形式,目前广为接受的是Singer和Nicholson于1972年提出的液态镶嵌模型(fluid mosaic model)学说。这一学说认为,液态脂质双层构成膜的基架,不同结构和功能的蛋白质镶嵌在其中,糖类分子与脂质、蛋白结合后附在膜的外表面(图2-1)。
(一)细胞膜的脂质
膜脂质主要由磷脂(phospholipid)、胆固醇(cholesterol)和少量糖脂(glycolipid)构成。在大多数细胞的膜脂质中,磷脂占总量的70%以上,胆固醇不超过30%,糖脂不超过10%。
磷脂是一类含有磷酸的脂类。磷脂中含量最多的是磷脂酰胆碱,其次是磷脂酰丝氨酸和磷脂酰乙醇胺,含量最低的是磷脂酰肌醇。
各种膜脂质在膜上的分布是不对称的。大部分的磷脂酰胆碱和全部的糖脂都分布在膜的外层,含氨基酸的磷脂(磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰肌醇)主要分布在膜的内层。
其中,磷脂酰肌醇的含量虽然很少,但可作为细胞内第二信使三磷酸肌醇(P,)和二酰甘油(DG)的供体,因而在跨膜信号转导中有重要作用(见第二节)。
脂质分子都是双嗜性分子(amphiphilic molecule)。例如,磷脂分子中含有磷酸和碱基的头端具有亲水性,含有较长脂肪酸的尾端具有疏水性。胆固醇分子中的羟基以及糖脂分子中的糖链具有亲水性,分子的另一端则具有疏水性。脂质分子的双嗜特性使之在质膜中以脂质双层(lipid bilayer)的形式存在,即两层脂质分子的亲水端分别朝向细胞外液或胞质,疏水的脂肪酸烃链则彼此相对,形成膜内部的疏水区。
质膜的疏水区是水以及水溶性物质如葡萄糖和各种带电离子的天然屏障,但脂溶性物质如氧气、二氧化碳以及乙醇等则很容易穿透。
膜脂质可因温度改变而呈凝胶或溶胶状态。正常人体温高于膜脂质的熔点,即已超过两种状态的转换温度,故膜脂质在人体内呈溶胶状态,具有一定程度的流动性。
除了与温度有关外,质膜的流动性还与膜脂质的成分及膜蛋白的含量有关。胆固醇分子具有不易变形的甾环结构,后者与脂肪酸链的结合可限制脂质的流动,故膜脂质中胆固醇含量愈高,膜的流动性就愈低 #? ;脂肪酸烃链长度愈长、饱和脂肪酸愈多,膜的流动性也愈低,如动物脂肪以饱和脂肪酸为主,室温下可呈固态;膜中镶嵌的蛋白质含量增多时也会降低膜的流动性。
(二)细胞膜的蛋白
细胞膜的功能主要是通过膜蛋白(membrane protein)实现的。根据膜蛋白在膜上的存在方式,可将其分为表面膜蛋白(peripheral membrane protein)和整合膜蛋白(integral membrane protein)两类(见图2-1)。 #细生
表面膜蛋白约占膜蛋白总量的20%~30%,主要附着于细胞膜的内表面。例如,膜骨架蛋白和锚定蛋白。前者属于结构蛋白,常以蛋白分子多聚体形成的长条细丝形式出现,可使质膜具有一定的强度和弹性;后者用于整合膜蛋白的定位,将其固定到特定的质膜位置。有的表面蛋白还以酶的形式发挥胞内信号转导作用或参与某些物质转运的控制。
表面蛋白通过静电引力与脂质的亲水部分相结合或通过离子键与膜中的整合蛋白相结合,但其结合力较弱。高盐溶液可使离子键断开,因而可用于表面蛋白从膜中的洗脱。
整合膜蛋白约占膜蛋白总量的70%~80%,它们以其肽链一次或反复多次穿越膜脂质双层为特征。穿越脂质双层的肽段以疏水性氨基酸残基为主,肽键之间易形成氢键,因而多以α螺旋结构的形式存在;露出膜外表面或内表面的肽段则是亲水性的,分别以直链形式构成连接疏水性α跨膜螺旋的细胞外环或细胞内环。一个α跨膜螺旋需18~21个氨基酸残基才能穿越厚约3nm的疏水区。因此,可根据肽链中所含的有足够长度的疏水性片段的数目来推测蛋白是否为跨膜蛋白及其跨膜次数。例如,G蛋白耦联受体的肽链包含7个有足够长度的疏水性片段,因而推测它是一个7次跨膜的蛋白。
整合膜蛋白与脂质分子结合紧密,在膜蛋白纯化过程中可用两性洗涤剂使之与脂质分离。一般来说,与物质跨膜转运功能和受体功能有关的蛋白都属于整合膜蛋白,如载体、通道、离子泵、G蛋白耦联受体等。也有一些整合膜蛋白作为黏附分子(adhesion molecule)在细胞与基质、细胞与细胞之间发挥作用。
各种功能蛋白质分子在质膜中的位置分布存在区域特性,这与细胞完成其特殊功能有关。例如,骨骼肌细胞膜上的N2型乙酰胆碱受体通常都集中在与神经末梢相对应的终板膜上,这与神经肌肉之间的信息传递有关;有髓神经纤维轴突膜上的电压门控钠通道几乎全部集中在裸露的郎飞结处,这与兴奋的发生和跳跃式传导(见后)有关。
(三)细胞膜的糖类
细胞膜中的糖类主要是一些寡糖和多糖链,它们以共价键的形式与膜蛋白或膜脂质结合而形成糖蛋白(glycoprotein)或糖脂(glycolipid)。大多数整合蛋白都是糖蛋白,近1/10的膜脂质是糖脂。
结合于糖蛋白或糖脂分子上的糖链几乎总是伸向细胞膜的外侧(被称为细胞“天线”),形成细胞的糖包被(glycocalyx)。细胞表面糖包被的相互接触可促进细胞之间的相互接触和作用;
许多糖类带有负电荷,这使得细胞表面呈现负电性,从而排斥带有负电荷的物质与其接触,如血液中红细胞之间能够保持分开状态就与膜上唾液酸(一种天然的碳水化合物)携带着负电荷有关;
许多糖类还作为一种分子标记发挥受体或抗原的功能。例如,霍乱毒素的受体就是一种称为GM1的糖脂;红细胞膜上ABO血型系统的抗原就是由糖蛋白或糖脂上不同的寡糖链所决定的,其中A型抗原和B型抗原的差别仅在于此糖链中一个糖基的不同(见第三章)。
二、跨细胞膜的物质转运
据估计,细胞用于物质转运的能量约占细胞耗能总量的2/3。
(一)单纯扩散
单纯扩散(simple diffusion)是指物质从质膜的高浓度一侧通过脂质分子间隙向低浓度一侧进行的跨膜扩散。这是一种物理现象,没有生物学转运机制参与,无需代谢耗能,属于被动转运,也称简单扩散。
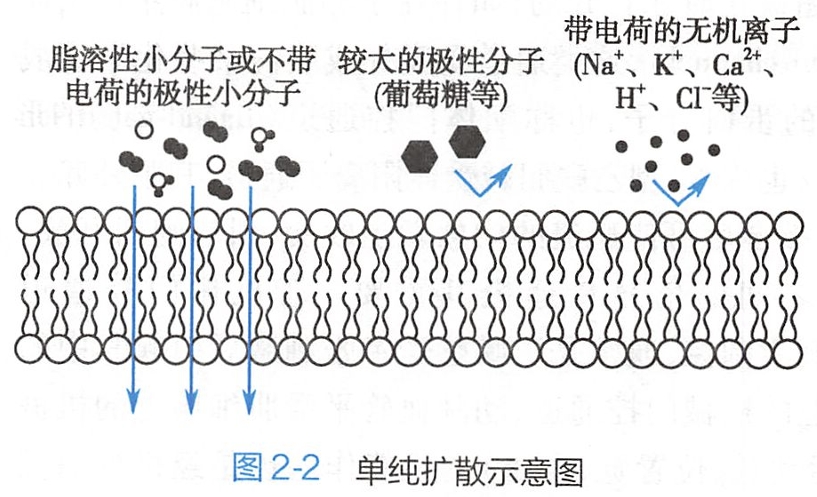
如图2-2所示,经单纯扩散转运的物质都是脂溶性(非极性)物质或少数不带电荷的极性小分子物质,如O2、CO2、N2、类固醇激素、乙醇、尿素、甘油、水等。
- 根据相似相溶原理,高脂溶性物质容易穿越脂质双层,因此O2、CO2、N2等高脂溶性小分子的跨膜扩散速度很快(如呼吸时肺毛细血管与肺泡之间的气体交换)。
- 水是不带电荷的极性小分子,也能以单纯扩散的方式通过细胞膜,但脂质双层对水的通透性很低,故扩散速度很慢(某些组织对水的通透性很大,是因为其细胞膜上存在水通道的缘故,见后);
- 分子较大的非脂溶性物质,如葡萄糖、氨基酸等,很难直接通过膜脂质双层;
- 各种带电离子,尽管其直径很小,却也不能通透膜脂质双层。
物质经单纯扩散转运的速率主要取决于被转运物在膜两侧的浓度差和膜对该物质的通透性。浓度差愈大、通透性愈高,则单位时间内物质扩散的量就愈多。另外,物质所在溶液的温度愈高、膜有效面积愈大,转运速率也愈高。
(二)易化扩散
易化扩散(facilitated diffusion)是指非脂溶性的小分子物质或带电离子在跨膜蛋白帮助下,顺浓度梯度和(或)电位梯度进行的跨膜转运。
根据跨膜蛋白及其转运溶质的不同,易化扩散可分为经通道的易化扩散和经载体的易化扩散两种形式。两者都属于被动转运,无需消耗ATP。
1.经通道的易化扩散 #细生
各种带电离子在通道蛋白的介导下,顺浓度梯度和(或)电位梯度的跨膜转运称为经通道的易化扩散(facilitated diffusion via channel)。由于经通道转运的溶质几乎都是离子,因而这类通道蛋白也称离子通道(ion channel)。
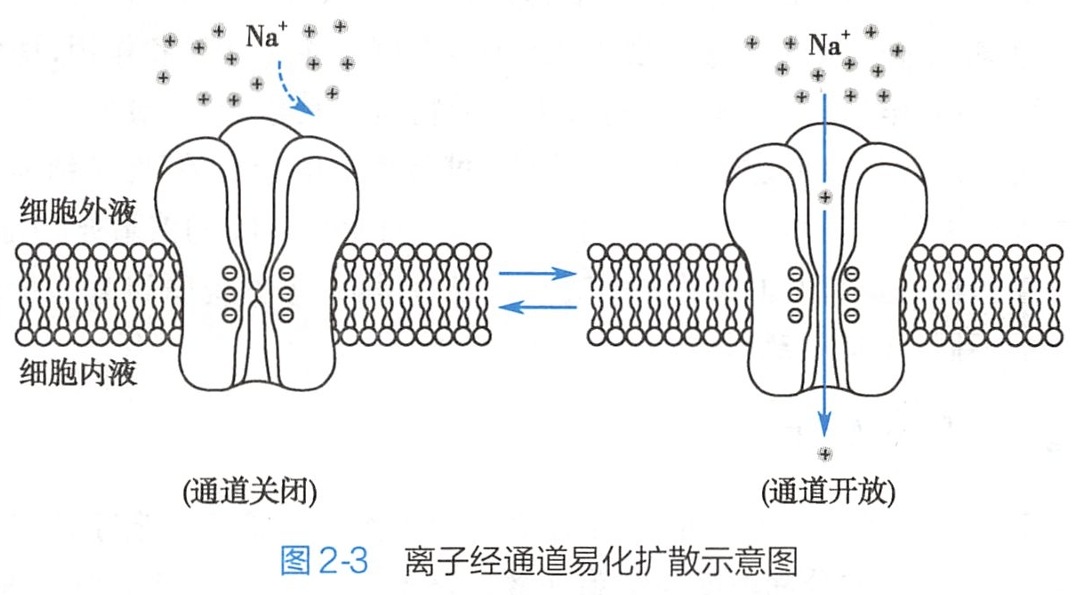
如图2-3所示,离子通道蛋白贯穿脂质双层、中央有亲水性孔道(pore)。当通道处于关闭状态时没有离子通过。
离子通道具有两个重要的基本特征:
(1)离子选择性:
离子选择性(ion selectivity)是指每种通道只对一种或几种离子有较高的通透能力,而对其他离子的通透性很小或不通透。
例如,钾通道对K+的通透性要比Na+大1000倍;乙酰胆碱受体阳离子通道对小的阳离子如Na+、K+高度通透,而Cl-则不能通透。
据此,可将通道分为钠通道、钙通道、钾通道、氯通道和非选择性阳离子通道等。
通道对离子的选择性取决于孔道的口径和带电状况等因素,如阳离子通道的内壁带负电荷,故有助于阳离子通过而阻碍阴离子通过(见图2-3)。此外,通道的离子选择性还与通道的形状、内壁的化学结构以及离子键分布等有关。
(2)门控特性:
大部分通道蛋白分子内部有一些可移动的结构或化学基团,在通道开口处起“闸门”作用。许多因素可引起闸门运动,导致通道的开放或关闭,这一过程称为门控(gating)。
在静息状态下,大多数通道的闸门都处于关闭状态,只有受到刺激时才发生分子构象变化,引起闸门开放。根据闸门对不同刺激的敏感性,即门控特性,可将离子通道分为:
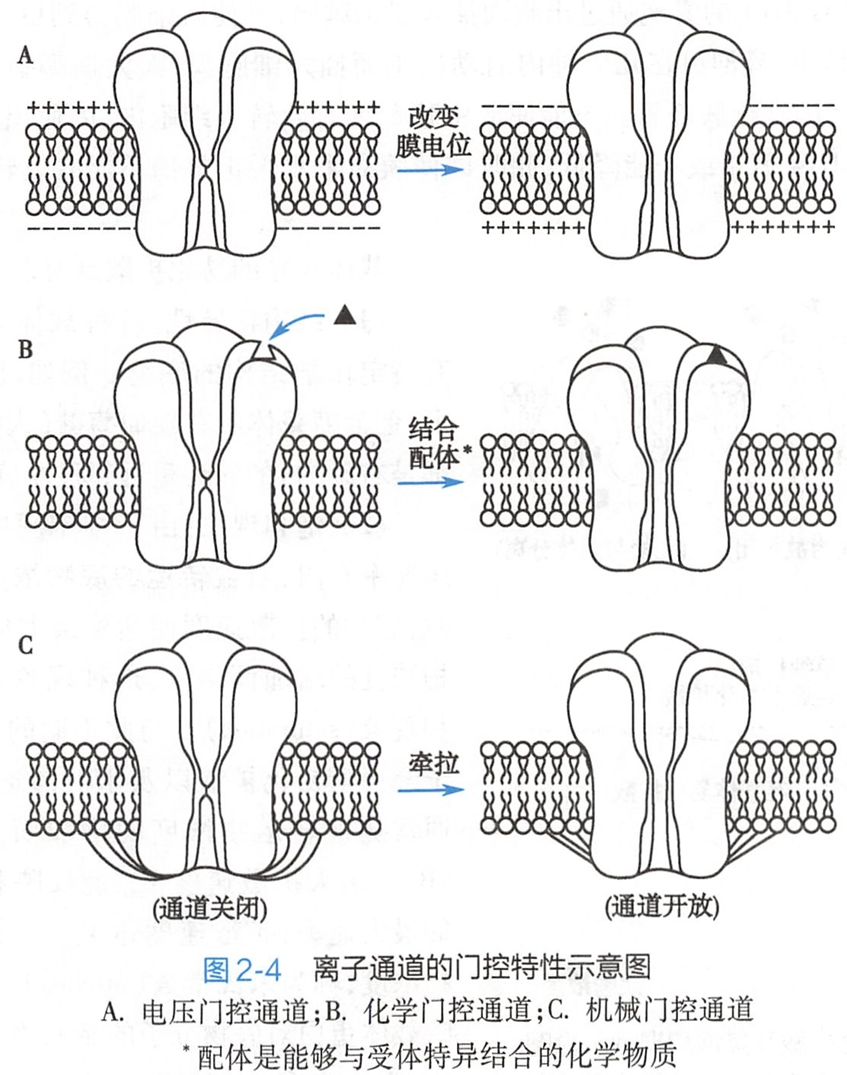
- 电压门控通道(voltage-gated ion channel),这类通道受膜电位调控(图2-4A)。当膜两侧电位差发生改变,通常是在膜发生去极化时,通道蛋白分子内的一些带电化学基团(也称电位感受区)发生移动,进而引起分子构象变化和闸门开放,如神经细胞轴突膜中的电压门控钠通道。电压门控通道的开放是神经或肌肉发生动作电位的基本机制。体内也有少量电压门控通道是在膜发生超极化时才打开的,如存在于心肌细胞膜中的If通道(见第四章)。
- 化学门控通道(chemical-gated ion channel),这类通道受膜外或膜内某些化学物质调控(图2-4B)。这是一类兼有通道和受体功能的蛋白分子,也称配体门控通道(ligand-gated ion channel),如骨骼肌终板膜上的N2型乙酰胆碱受体,也称N2型乙酰胆碱受体阳离子通道,其膜外侧有两个乙酰胆碱结合位点,结合位点与乙酰胆碱分子结合后可使通道的构象发生改变,引起闸门开放。化学门控方式对神经元之间或神经元与肌肉之间的信号传递极其重要。
- 机械门控通道(mechanically-gated ion channel),这类通道受机械刺激调控,通常是质膜感受牵张刺激后引起其中的通道开放或关闭(图2-4C),如耳蜗基底膜毛细胞上的机械门控通道、动脉血管平滑肌细胞上的机械门控钙通道等。某些感受器细胞(如触觉、听觉、运动觉、位置觉、血压)的换能作用也是经机械门控通道介导的。
- 此外,也有少数通道始终是开放的,这类通道称为非门控通道,如神经纤维上的钾漏通道 potassium leak channel)。
细胞膜中除离子通道外,还存在水通道(water channel)。如前所述,水分子可以单纯扩散的方式通过细胞膜,但膜脂质对水的通透性很低,扩散速度很慢。事实上,某些细胞对水的转运速率可达到惊人的程度。例如,红细胞每秒允许百倍于自身容积的水通过其质膜,若将红细胞置于低渗溶液中,水很快进入细胞内,使之膨胀而发生溶血;此外,肾小管、集合管、呼吸道以及肺泡等处的上皮细胞对水的转运能力也很强。在这些细胞的质膜中,存在着大量对水高度通透且总是开放的水通道。
组成水通道的蛋白称为水通道蛋白(aquaporin,AQP),其水相孔道只能允许水分子以单列形式扩散通过。各种离子水化后因直径加大,因而不能通过水通道。
某些细胞膜上水通道密度还可受生理性调控,如肾小管上皮细胞膜上水通道的数量可因抗利尿激素水平的升高而增加,这是尿浓缩的机制(见第八章)。
2.经载体的易化扩散
载体(carrier)也称转运体(transporter),是介导多种水溶性小分子物质或离子跨膜转运的一类整合膜蛋白。
与离子通道或水通道不同,各种载体或转运体不存在贯穿整个细胞膜的孔道结构,但能与一个或少数几个溶质分子或离子特异性结合。
经载体的易化扩散(facilitated diffusion via carrier)是指水溶性小分子物质在载体蛋白介导下顺浓度梯度进行的跨膜转运,属于载体介导的被动转运(载体介导的主动转运见后)。
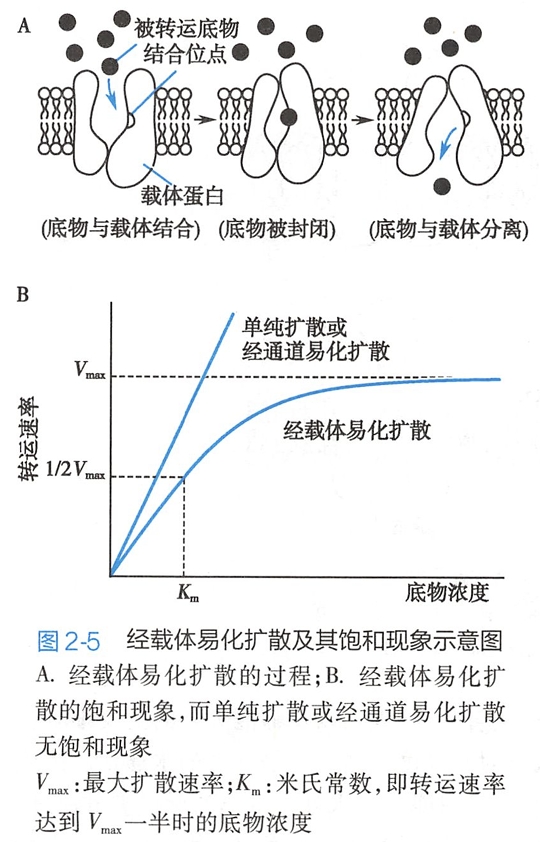
如图2-5A所示,当载体上的结合位点朝向被转运物浓度较高的一侧时,结合位点与底物(指被转运物)分子结合的概率较高;与底物结合后,载体蛋白发生构象改变,底物被封闭(occlude)于载体蛋白内,随之结合位点朝向底物浓度较低的膜的另一侧;于是底物从结合位点上解离并释放到膜的另一侧。当膜两侧的底物浓度相等时,底物的净转运为零。
由于载体转运时载体蛋白需经历“与底物结合-构象变化-与底物解离”等一系列过程,因此物质经载体转运的速率较慢,远低于离子通道或水通道的转运速率。
体内许多重要的物质如葡萄糖、氨基酸等的跨膜转运就是经载体易化扩散实现的,如葡萄糖转运体(glucose transporter,GLUT)可将胞外的葡萄糖顺浓度梯度转运到细胞内。GLUT有多种类型,分布于不同的组织细胞。其中,GLUT1表达于多种组织细胞,是一种基本的葡萄糖转运体;GLUT4分布于横纹肌和脂肪等组织,基础状态下主要储存于胞质内的囊泡膜中,可受肌肉活动的影响和胰岛素的调节。肌肉活动时,含GLUT4的囊泡通过出胞而插入肌细胞膜,可使肌细胞得到更多的葡萄糖;血中胰岛素水平增高时,GLUT4囊泡可在几分钟内启动出胞而插入细胞膜,大大提高细胞转运葡萄糖的能力。有些糖尿病患者因缺乏胰岛素而不能使血中葡萄糖有效转入细胞内,因而出现高血糖。有些糖尿病患者常伴有GLUT4数量或功能降低,此时即使胰岛素水平正常仍不能有效转运葡萄糖,出现胰岛素抵抗。
载体介导的易化扩散具有以下特点:
(1)结构特异性
各种载体只能识别和结合具有特定化学结构的底物。例如,同样浓度差的情况下,葡萄糖载体对右旋葡萄糖(人体内可利用的糖类都是右旋的)的转运量远超过左旋葡萄糖。
(2)饱和现象
由于细胞膜中载体的数量和转运速率有限,当被转运的底物浓度增加到一定程度时,底物的扩散速度便达到最大值,不再随底物浓度的增加而增大,这种现象称为载体转运的饱和现象(saturation)。
与此不同的是,在单纯扩散、离子经通道易化扩散以及水的渗透过程中,转运速率通常随被转运物浓度的增加而呈线性增加(图2-5B)。最大扩散速度Vmax能反映载体蛋白构象转换的最大速率;扩散速度达Vmax一半(1/2Vmax)时的底物浓度,称为米氏常数(Michealis constant,Km),可反映载体蛋白对底物分子的亲和力和转运效率。Km愈小,表示亲和力和转运效率愈高,反之亦然(图2-5B)。
(3)竞争性抑制
如果有两种结构相似的物质都能与同一载体结合,两底物之间将发生竞争性抑制(competitive inhibition)。其中,浓度较低或Km较大的溶质更容易受到抑制。
(三)主动转运
主动转运(active transport)是指某些物质在膜蛋白的帮助下,由细胞代谢提供能量而进行的逆浓度梯度和(或)电位梯度跨膜转运。完成主动转运的膜蛋白本质上也属于载体,也有同被转运底物特异性结合的特征。
根据膜蛋白是否直接消耗能量,主动转运可分为原发性主动转运和继发性主动转运。一般所说的主动转运是指原发性主动转运。
1.原发性主动转运
细胞直接利用代谢产生的能量将物质逆浓度梯度和(或)电位梯度转运的过程称为原发性主动转运(primary active transport)。
原发性主动转运的底物通常为带电离子,因此介导这一过程的膜蛋白或载体被称为离子泵(ion pump)。离子泵的化学本质是ATP酶,可将细胞内的 ATP水解为ADP,自身被磷酸化而发生构象改变,从而完成离子逆浓度梯度和(或)电位梯度的跨膜转运。
离子泵种类很多,常以它们转运的离子种类命名,如钠-钾泵、钙泵、质子泵等。
(1)钠钾泵:
钠钾泵(sodium-potassium pump)是哺乳动物细胞膜中普遍存在的离子泵,简称钠泵。
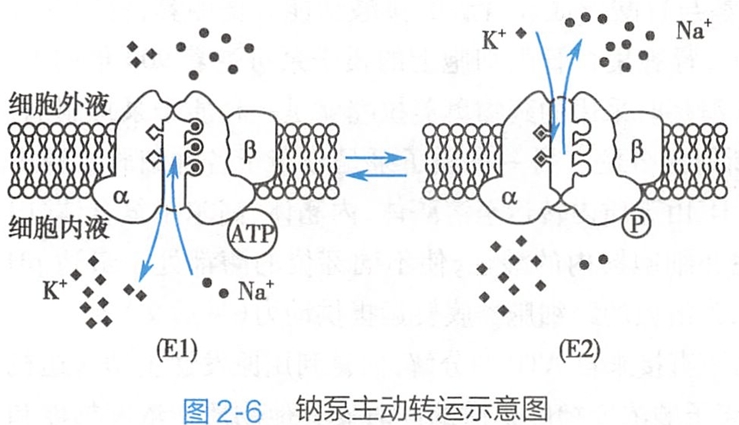
如图2-6所示,钠泵是由两个亚单位组成的二聚体蛋白质。其中,亚单位是催化亚单位,钠泵也称钠-钾依赖式ATP酶(Na+,K+-ATPase)。
α亚单位上有3个Na+、2个K+和一个ATP分子的结合位点,可表现为E1和E2两种主要构象。
- 当α亚单位与ATP结合时,构象为E1,离子结合位点向细胞内侧,此时亚单位对K+亲和力较低而对Na+亲和力较高,使已结合的2个K+释放到细胞内,并与细胞内3个Na+结合;
- 结合Na+后,亚单位的ATP酶活性被激活,ATP分解,α亚单位被磷酸化,构象由E1转变为E2,离子结合位点朝向细胞外侧,这时α亚单位对Na+亲和力降低而对K亲和力增高,使已结合的3个Na+释放到细胞外,并与胞外的2个K+结合;
- 结合K+后,α亚单位发生去磷酸反应,再次与另一分子的ATP结合并触发构象由E2回到E1,从而完成了钠泵的一个转运周期。
因此,钠泵每分解一分子ATP可逆浓度差将3个Na+移出胞外,将2个K+移入胞内,其直接效应是维持细胞膜两侧Na+和K+的浓度差,使细胞外液中的Na+浓度达到胞质内的10倍左右,细胞内的K+浓度达到细胞外液的30倍左右。
同时,钠泵每次活动都会使3个Na+移出胞外、2个K+移入胞内,产生一个正电荷的净外移,故钠泵具有生电效应。
一般认为,细胞膜上钠泵活动的生理意义主要有:
- 钠泵活动造成的细胞内高K+为胞质内许多代谢反应所必需,如核糖体合成蛋白质就需要高K+环境。
- 维持胞内渗透压和细胞容积。在静息状态下,膜对Na+、K+都有一定通透性(K+漏通道)。虽然这时K+的通透性相对较高,但由于膜内有机负离子(带负电的蛋白质、核苷酸等)的吸引,外漏的K+较少,而Na+受浓度差和电位差的驱动漏入到胞内的数量则相对较多。钠泵的活动可将漏入胞内的Na+不断转运出去,保持细胞正常的渗透压和容积,以防细胞水肿。
- 钠泵活动形成的Na+和K+跨膜浓度梯度是细胞发生电活动如静总息电位和动作电位的基础(见本章第三节)。
- 钠泵活动的生电效应可使膜内电位的负值增大,直接参与了静息电位的形成(见本章第三节)。
- 钠泵活动建立的Na+跨膜浓度梯度可为继发性主动转运提供势能储备(见后文)。
钠泵抑制剂哇巴因(ouabain)与钠泵E2状态下的细胞外部结构有较高的亲和力,可以改变钠泵构象,阻断钠泵活动。
(2)钙泵:
钙泵(calcium pump)是哺乳动物细胞上广泛分布的另一种离子泵,也称Ca2+-ATP酶。钙泵不仅位于质膜上,还集中分布于肌细胞的肌质网和其他细胞的内质网膜上。
质膜上的钙泵称为质膜钙ATP酶(plasma membrane Ca-ATPase,PMCA),肌质网和内质网膜上的钙泵称为肌质网和内质网钙ATP酶(sarcoplasmic and endoplasmic reticulum calcium ATPase,SERCA)。
钙泵的话动原理类似于钠泵,不同的是钙泵具有特异性的Ca2+结合位点,当胞质内Ca2+浓度升高时,Ca2+通过与钙调素(calmodulin,CaM)蛋白的结合可刺激钙泵活动。
PMCA每分解1分子ATP,可将其结合的1个Ca2+由胞质内转运至胞外;SERCA则每分解1分子ATP可将2个Ca2+从胞质内转运至内质网中。两种钙泵的共同作用可使胞质内游离Ca2+浓度保持在0.1~0.2μmol/L的低水平,仅为细胞外液Ca2+浓度(1~2mmol/L)的万分之一。
在如此低浓度的游离Ca2+背景下,细胞对胞质内Ca2+浓度的增加将变得非常敏感,以致经钙通道流入胞质内的Ca2+成为触发或激活许多生理过程如肌细胞收缩、腺细胞分泌、神经递质释放以及某些酶蛋白或通道蛋白的激活等的关键因素。
(3)质子泵:
人体内有两种重要的质子泵(proton pump)。
一种是主要分布于胃腺壁细胞和肾脏集合管闰细胞顶端膜上的H+,K+-ATP酶(也称氢钾泵)。氢钾泵与钠钾泵同属一个家族,也由两个亚单位组成,α亚单位的活动机制类似于钠-钾泵。但氢-钾泵的主要功能是分泌H+和摄入K+,可逆浓度梯度将H+有效地分泌到胃液或尿液中,分别参与胃酸形成和肾脏的排酸功能。
临床上治疗胃溃疡和十二指肠溃疡时采用的药物奥美拉唑就是一种质子泵抑制剂,可特异性结合并抑制胃腺壁细胞的质子泵,阻断胃酸分泌。
另一种质子泵是分布于各种细胞器膜中的H+-ATP酶,也称氢泵。氢泵不依赖K+,可将H+由胞质内转运至溶酶体、内涵体、高尔基复合体、内质网、突触囊泡等细胞器内,以维持胞质的中性和细胞器内的酸性,使不同部位的酶都处于最适H+环境,同时也建立起跨细胞器膜的H+浓度梯度,为溶质的跨细胞器膜转运提供动力(见后文)。
2.继发性主动转运
某些物质的主动转运不直接来自ATP的分解,而是利用原发性主动转运机制建立起的Na+或H+的浓度梯度,在Na+或H+离子顺浓度梯度扩散的同时使其他物质逆浓度梯度和(或)电位梯度跨膜转运,这种间接利用ATP能量的主动转运过程称为继发性主动转运(secondary active transport)。
显然,继发性主动转运依赖于原发性主动转运,若用药物(如哇巴因)抑制钠泵活动,相应的继发性主动转运将会逐渐减弱,甚至消失。
与易化扩散时只转运一个底物分子的载体即单转运体(uniporter)不同,继发性主动转运的载体同时要结合两种或两种以上的分子或离子才能引起载体蛋白的构象改变。根据这些物质的转运方向,继发性主动转运又分为同向转运和反向转运两种形式。
(1)同向转运
被转运的分子或离子都向同一方向运动的继发性主动转运称为同向转运(sym port),其载体称为同向转运体(symporter)。
例如,葡萄糖在小肠黏膜上皮的吸收以及在近端肾小管上皮的重吸收是通过钠-葡萄糖同向转运体实现的。其中,Na+在上皮细胞顶端膜两侧浓度梯度和(或)电位梯度的作用下,被动转入胞内;葡萄糖分子则在Na+进入细胞的同时逆浓度梯度被带入胞内。
Na+-葡萄糖同向转运体在小肠黏膜是以2个Na+和1个葡萄糖同时转运的,在肾小管处则是以1个Na+和1个葡萄糖进行转运。氨基酸在小肠的吸收是通过Na+-氨基酸同向转运体以同样的方式进行的。
此外,肾小管上皮细胞的Na+-K+-2Cl-同向转运体、Na+-HCO3-同向转运体、甲状腺上皮细胞的 Na+-I-同向转运体以及突触前膜对单胺类递质再摄取等都属于Na+依赖性转运体介导的同向转运。
(2)反向转运
被转运的分子或离子向相反方向运动的继发性主动转运称为反向转运(antiport)或交换(exchange),其载体称为反向转运体(antiporter)或交换体(exchanger)。
人和高等动物体内有两种重要的交换体:
- Na+-Ca2+交换体:是一类可同时结合Na+与Ca2+并进行反向跨膜运输的转运体,广泛分布于细胞的质膜和其他膜性结构上。质膜上的Na+-Ca2+交换体通常是在Na+顺电化学梯度进入细胞内的同时,将细胞内的Ca2+逆浓度梯度转运到细胞外,与维持细胞内Ca2+稳态有关。例如,心肌细胞在兴奋-收缩耦联过程中流入胞内的Ca2+主要是通过Na+-Ca2+交换体将Ca2+排出细胞的。几乎所有细胞都存在Na+-Ca2+交换体,且多以转入3个Na+和排出1个Ca2+的化学计量进行转运。
- Na+-H+交换体:是同时结合Na+与H+并完成反向跨膜转运的膜蛋白。部分组织细胞表达Na+-H+交换体,肾小管近端小管上皮细胞的顶端膜则分布较多,其可将胞外即肾小管管腔内的1个Na+顺电化学梯度重吸收进入细胞内,同时将胞内的1个H+逆浓度梯度分泌到管腔中,这对维持机体的酸碱平衡具有重要意义。
在绝大多数情况下,溶质跨质膜转运的动力来自钠泵活动建立的Na+的跨膜浓度梯度,而溶质跨细胞器膜转运的动力则来自质子泵活动建立的H+的跨膜浓度梯度,如突触囊泡膜中的单胺类递质转运体,就是与囊泡内高浓度的H+交换而实现的,囊泡每排出2个H+,可将1个单胺类分子转入囊泡内。
(四)膜泡运输
大分子和颗粒物质进出细胞并不直接穿过细胞膜,而是由膜包围形成囊泡,通过膜包裹、膜融合和膜离断等一系列过程完成转运,故称为膜泡运输(vascular transport)。
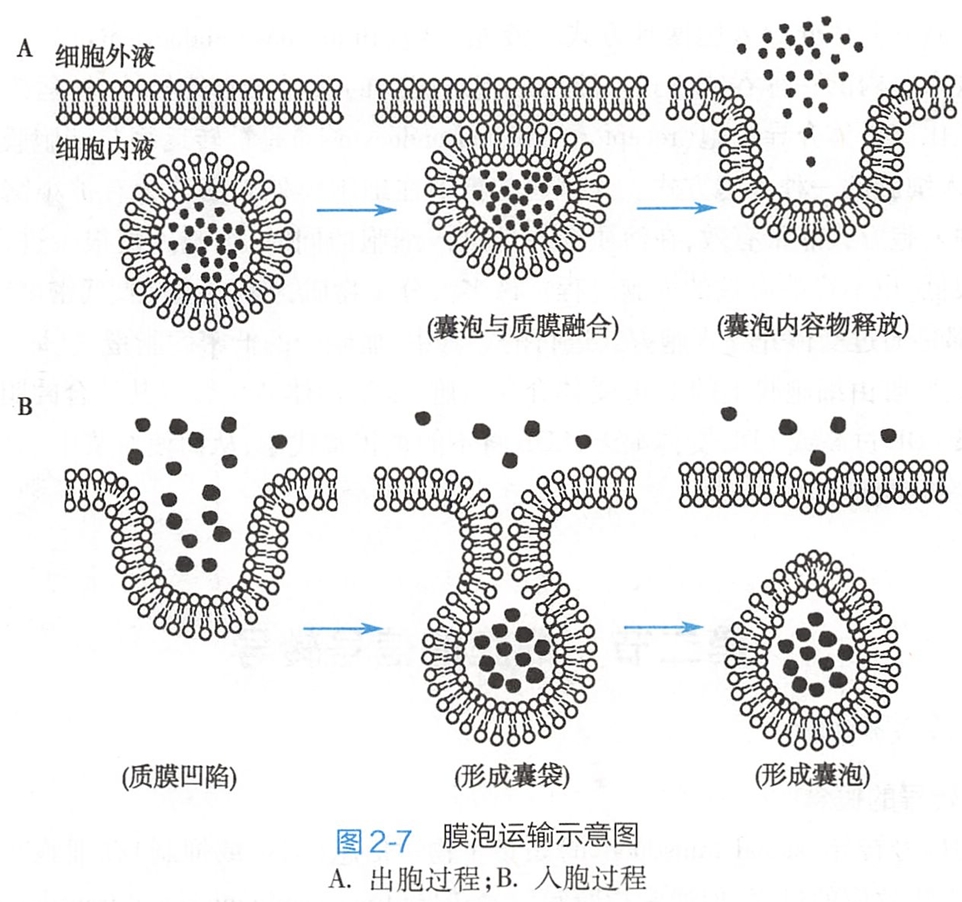
膜泡运输可同时转运大量物质,故也称批量运输(bulk transport)。膜泡运输是一个主动的过程,需要消耗能量,也需要更多蛋白质参与,同时还伴有细胞膜面积的改变。膜泡运输包括出胞和入胞两种形式(图2-7)。
1.出胞
出胞(exocytosis)是指胞质内的大分子物质以分泌囊泡的形式排出细胞的过程。
例如,外分泌腺细胞排放酶原颗粒和黏液、内分泌腺细胞分泌激素、神经纤维末梢释放神经递质等过程都属于出胞。
几乎所有的分泌物都是通过内质网-高尔基体系统形成和处理的。由粗面内质网上核糖体合成的蛋白质可转移到高尔基体加工处理,形成具有膜包裹的分泌囊泡。出胞时,在多种蛋白质的介导下,囊泡逐渐移向细胞膜的内侧,并与细胞膜发生融合、破裂,最后将其内容物释放到细胞外(图2-7)。
由于在出胞过程中囊泡膜与质膜融合,因而会使细胞膜表面积有所增加。出胞有两种形式:
- 持续性出胞:持续性出胞是指细胞在安静情况下,分泌囊泡自发地与细胞膜融合而使囊泡内大分子物质不断排出细胞的过程,如小肠黏膜杯状细胞分泌黏液的过程。
- 调节性出胞:调节性出胞是指细胞受到某些化学信号(如激素)或电信号(如动作电位)的诱导时,储存于细胞内某些部位的分泌囊泡大量与细胞膜融合,并将囊泡内容物排出细胞的过程,如动作电位到达神经末梢时引起的神经递质释放。
2.入胞
入胞(endocytosis)是指细胞外大分子物质或物质团块如细菌、死亡细胞和细胞碎片等被细胞膜包裹后以囊泡形式进入细胞的过程,也称内化(internalization)。
进入细胞后的囊泡随即被溶酶体进行处理。与出胞相反,入胞过程可使细胞膜面积有所减小。
入胞也可分为两种形式:
- 吞噬:被转运物质以固态形式进入细胞的过程称为吞噬(phagocytosis)。吞噬所转运的物质不是以分子而是以团块或颗粒形式出现,如细菌、死亡细胞或组织碎片等。吞噬发生时,细胞膜在膜受体和收缩蛋白参与下伸出伪足,逐渐将团块或颗粒包裹起来,经膜融合、离断后进入胞内,形成直径较大的膜性囊泡(1~2m),即吞噬泡。吞噬仅发生于一些特殊的细胞,如组织中的巨噬细胞和血细胞的中性粒细胞等。当机体发生炎症时,血液中的中性粒细胞与单核细胞数量会增多。它们可迅速穿越血管内皮进入感染部位,其中单核细胞转化成巨噬细胞,后者与中性粒细胞共同发挥吞噬病原体的作用。
- 吞饮:被转运物质以液态形式进入细胞的过程称为吞饮(pinocytosis)。吞饮可发生于体内几乎所有的细胞,是多数大分子物质如蛋白质分子进入细胞的唯一途径。当这些大分子物质接触到细胞膜时,吞饮活动增强。这时,细胞在接触转运物质处发生膜的凹陷,逐渐形成囊袋样结构包裹被转运物,再经膜的融合、离断、进入胞内,形成直径较小的囊泡(0.1~0.2m)即吞饮泡(图2-7B)。吞饮又可分为液相入胞和受体介导入胞两种方式。(分类与细生不一样)
- 液相入胞(fluid-phase endocytosis)是指溶质连同细胞外液连续不断进入胞内的一种吞饮方式。液相入胞对底物的选择没有特异性,转运溶质的量与胞外溶质的浓度成正比。
- 受体介导入胞(receptor-mediated endocytosis)是被转运物与细胞膜受体特异性结合后,选择性进入细胞的一种入胞方式。受体通常集中在细胞膜外表面称为有被小窝(coated pit)的凹陷之处。这种入胞方式非常有效,在溶质选择性进入细胞的同时,细胞外液很少进入;而且即使胞外溶质的浓度很低,也不影响有效的入胞过程。许多大分子物质,如运铁蛋白、低密度脂蛋白、维生素B2转运蛋白等都是通过受体介导入胞方式进行的。其中,血浆中的低密度脂蛋白(low-density lipoprotein,LDL)主要在肝脏由细胞膜上的LDL受体介导入胞,被溶酶体消化后将其结合的胆固醇释放出来以供利用。如果LDL过高或LDL受体缺乏,LDL将不能被正常代谢,从而使血浆中LDL浓度升高,引起高胆固醇血症和动脉硬化。 #细生